生物由来製品の感染症に関する記録の保存についての考え方(案)
1 感染症に関する記録の保管に係る改正薬事法第68条の9(要旨)
|
「生物由来製品」については、製品による感染症が万一発生した場合の調査等を可能とするため、関係者が必要な事項の記録・保存等をしなければならないこととすること。
|
2 国会審議における論点
|
生物由来製品、特定生物由来製品の製造記録(新法第14条第6項/法第13条の2)、使用記録(法第68の9第8項)は、諸外国の例を参考とし、十分な期間設定する(参議院付帯決議)
|
3 基本的考え方(検討の方向性)
| (1) | 感染症が万が一発生した場合に、感染拡大防止のための安全対策を講ずるために必要な期間 |
| (2) | 救済の観点から、遅発性の感染症の発症者を合理的可能な限り救済していく観点から必要な期間 |
| (3) | 外国での状況を参考とする。 |
4.現時点での検討状況における案
表1 記録の保存期間のまとめ
| 製品の分類 | 医療機関での患者使用記録の保存期間 | 製造業者等での提供者・製造記録の保存期間 | |
| 特定生物由来製品 | 20年※ (理由) vCJDも含め、感染発症の把握性を高めるため。 |
30年 (理由) 人由来成分についてのvCJD等の長期のリスクの可能性に備えた対応のため。動物由来についても予防的に同様の考え方を適用。 |
|
| 生物由来製品 | 人血液成分以外の成分に関する記録 | − | 10年 (理由) 予防的なBSE対策等によりプリオン病に対するリスクの蓋然性はほとんどないため。 |
| 人血液成分を含む場合の人血液成分に関する記録 | − | 30年 (理由) 人由来成分についてのvCJD等の長期リスクの可能性に備えた対応のため。 |
|
| ※ | 改正薬事法第68条の9: | 特定生物由来製品は医療機関における使用記録の保存が求められている。 |
5.期間の根拠
| (1) | 安全対策において、感染者が出始めたところで、速やかに措置をする観点からは、想定される感染症の大方の潜伏期間をカバーする保存期間が最低限必要。→ 行政への報告、さらなる二次感染等の防止の対応
|
| (2) | 感染被害救済においては、合理的に想定される最長の潜伏期間を最大限カバーする保存期間が必要。→ 使用と製品との関連を示すための記録としての利用
|
| (3) | 未知の感染症への対応については、現時点では未知のものであり、現在知られている感染症を基礎として検討する。新たなタイプの感染症が発生した場合は、その時点での再検討が必要な場合があることに留意。 |
6.記録の保存期間と対象となる製品
| (1) | 特定生物由来製品は、主として血液製剤を含み、血液製剤については、現時点でも人から人へのウイルス性の感染症及びプリオン型感染症の伝播のリスクが高く、プリオン型の感染症を想定した期間の設定が必要。動物由来の特定生物由来製品についても、本質的な感染リスクが高いことからも、予防的に同様の措置を講ずる必要がある。 |
| (2) | 生物由来製品については、BSE対策において、プリオン型の感染因子を持ちうる反芻動物の使用禁止に係る規制を徹底していることから、プリオン型の感染症に関するリスクは考えにくいため、ウイルス性の感染症を想定した期間の設定が必要。(ただし、人血液成分を製造工程において使用する場合は、その分につき、特定生物由来製品と同様の記録の保存を行う。) |
7.記録の保管対象者
| (1) | 医薬品等の製造業者等は、感染被害救済にも対応できるよう、感染被害救済の観点から十分な期間を保管。(製造記録(採血記録を含む)、販売先記録) |
| (2) | 医療機関においては、感染リスクの高いものについて、感染発症を早期に捕獲するという安全対策上の観点から、合理的により長期の期間を保管。(使用記録) |
8.保管する記録の内容
| (1) | 記録の保管において、製造業者等(採血事業者が記録の作成、保管を行う場合を含む。)は、血液製剤にあっては採血記録(感染症スクリーニング検査結果等を含む)、製造記録(原料に関する採血記録等の由来を含む。)、ロット記録、出荷先医療機関等に関する書類(電子媒体を含む。)を保管しなくてはならない。 |
| (2) | 医療機関においては、投与日(処方日)、投与患者の氏名、住所、製品名、製品のロット番号・記号について管理簿を作成し、保存することとする。 |
| (3) | 特定生物由来製品については、未知の感染症の発生を含む感染症に係る安全対策を実施する上での原因究明に供するため、書面での記録に加え、10年の製品ロット又は採血サンプルの保管を求めるものとする。 |
| ※ | プリオン病については、現時点ではサンプルレベルで有効な検査法がなく、書面の使用記録等があれば対応できるため、一般のウイルス型の感染症を当面対象として10年とするという小委員会の意見に基づく。 |
9.外国での記録の保管の実態
| (1) | 現在、血液製剤について、長期の記録保管を義務づけている国があるが、いずれもプリオン型の感染症を対象としたものはない。 |
| (2) | EUにおいて、プリオン病(vCJD)を考慮し、その因果関係の究明等の理由で30年の記録の保管を採血業者に義務づけるEC指令が欧州議会で法制化された。 |
(参考)保管記録の内容について
| ※ | EC指令での採血等の記録保存の内容は、「献血者から使用者までを遡及できる一連の記録として、献血者それぞれに識別でき、また、血漿、成分等の種別」(欧州血液指令第14条)が最低限必要であるが、具体的な記録の種類については明らかにされていない。(現行のフランス、ドイツの規制においては採血時の検査記録等が含まれている。) |
| ※ | EC指令においては、医療機関における記録の保存は規定されていないが、現行フランスにおいては、医療機関において、使用した血液製剤のロット情報と患者の特定情報を記録することをもって遡及を行うこととしている。 |
| ※ | 米国連邦規則第21巻1271条(案)において、細胞・組織製品について課されている記録については、ドナースクリーニング、細胞組織の受け入れ、製造記録に至るまでの記録に関する保管が義務づけられている。なお、医療機関での使用記録については、ドナーと使用者を結びつける識別番号等を利用した対応を図ることとされている。 |
| ※ | 米国での血液製剤については、採血時の検査記録等を保管し、輸血用血液製剤は、供血者から使用者までの遡及ができるようにすること、血漿分画製剤については供血者から原料血漿までの遡及ができる体制としている。 |
表2 諸外国の血液製剤等の記録の保管期間・対象について
| 国名 | 製品対象 | 保管義務者 | 記録保管年限 | 医療機関のカルテ保管年限 | 備考 |
| 米国 | 血漿分画製剤 輸血用血液製剤 移植用硬膜 |
採血施設 製造事業者 |
10年 (移植用硬膜は16年指導) |
5年 | |
| ドイツ | 血漿分画製剤 輸血用血液製剤 |
採血業者 血液製剤業者 医療機関 |
15年 | 10年 | |
| フランス | 血漿分画製剤 輸血用血液製剤 |
採血業者 血液製剤業者 医療機関 |
40年 | 40年 | カルテ保存期間に合わせたもの |
| 英国 | 輸血用血液製剤 | 採血業者 | 15〜30年 | 8年 | 英国には、規制による要件はない。 |
| EU全域 | 血漿分画製剤 輸血用血液製剤 その他血漿成分 |
採血業者(ただし、製剤業者、医療機関への義務づけは各国の裁量) | 30年 | − | 血液を介したvCJDの可能性を踏まえたもの(14年12月欧州議会で可決) |
表3 プリオン型の感染症の過去の感染事例と潜伏期間について
| 感染方法(物質) | 投与方法 | 平均潜伏期間(幅) |
| 人角膜移植 | 視神経 | 17ヶ月(16 - 17年)* |
| 人乾燥硬膜 | 脳表面 | 5.5 年(1.5 - 12年)* 7.4 年(1.3 - 16 年)** |
| 人成長ホルモン(脳由来) | 血中 | 12年 (5-30年)* 12年 (5-39年)** |
| 人ゴナドトロピン | 血中 | 13年 (12 - 16年)* |
| ※ | Maneulidis EE. et al. Proc Soc Exp Biol Med 1979; 160; 233 |
| ※※ | FDA公表資料(David Asher 氏) |
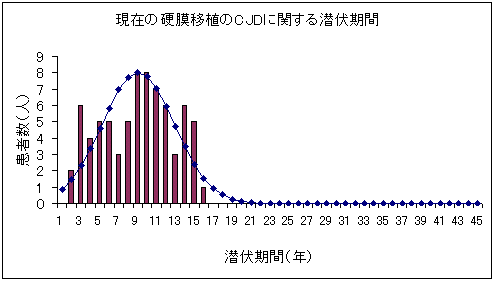
図1 CJDの潜伏期間予測


図1−プリオン型の感染症を想定した場合の将来に渡る潜伏期間と人数の推定について
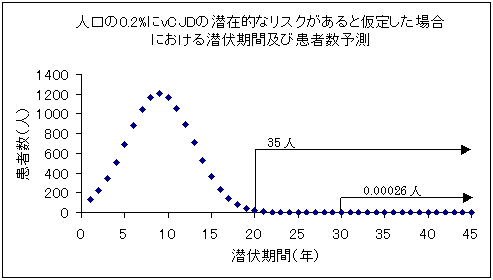
| (1) | 英国におけるBSE原因説に基づく、将来的なvCJDの感染推計においては、英国内で最大14万人のvCJD患者が発生するとも推計されている。(現在の英国の人口の0.2%)Predictes vCJD mortality in Great Britain. Modelling the latest data puts a ceiling on the likely number of vCJD cases. Nature 2000;406:583-584 |
| (2) | 最大人口の0.2%の確率での輸血に由来する感染が起こりうるという最悪のシナリオに基づいて想定すると、国内でも最大1万1600人がvCJDに感染すると推定される。(580万人(人口の0.2%)分が輸血用血液製剤として使用され、使用者が100%感染の最悪のシナリオ) |
| (3) | もっとも遅い感染者の発症時期を予測するため、現在の硬膜移植のCJDに関する潜伏期間データの分散を正規分布に当てはめ、1万1600人の感染者の発生の潜伏期間の分布を予測すると、感染20年後で35人程度、30年とすると一人未満(0.00026人)となる。30年の記録の保存期間を設定すれば、CJD型の疾患であっても統計的には感染を捕捉することが可能という計算となる。 |
| 注: | これはあくまでも最悪のシナリオであり、現在までに輸血等によるCJD感染が因果関係を含め、確認された知見は得られていない。 |
| 参考 |
医療機関等の業廃止時における記録保存について
| ○ | 医療機関が廃止される場合の特定生物由来製品の記録の取り扱いについて |
医療機関が廃止された場合であっても、感染症拡大防止の観点、感染等救済の観点から、使用に関する記録が確保されていることが必要との議論については次の2つの試案について行政サイドにおいても当面検討を進める。
1.医療機関から製造業者等(承認取得者)への記録の提供する案
| (1) | 薬事法第68条の9第4項において、医療機関は、承認取得者からの要請に基づいて、保健衛生上の危害の発生又は拡大を防止するための措置が必要と認められる場合であって、使用対象者の利益になるときに限り、記録を承認取得者に提供するものとするとされている。(この記録に関して製造業者等には法的な守秘義務がかかっている。) |
| (2) | 廃止される医療機関においては、安全対策及び救済における患者の利益を考慮し、製造企業等との連携の下に当該特定生物由来製品の記録を製造業者等に提供し、製造業者において保存するという方法。 |
2.医療機関から地域の保健所等の公的な機関に記録を提供する案
行政指導に基づき、廃止される医療機関のカルテ等の記録を地域の保健所が引き続き保存している自治体もあることから、当該特定生物由来製品の記録を地域の保健所に併せて引継ぐという方法。
○ 製造業者等が業廃止する場合の記録の取り扱いについて
1.承継先の企業に記録を提供する原則
生物由来製品及び特定生物由来製品に関して製造業者が保存している製造・使用の記録については、業廃止時に、承認等を承継する企業に対して引継ぐことを原則とする。
2.その他
承継する企業がない場合については、行政当局と当該企業の間で、記録の取扱いについて事前に協議を行い、対応を行うこととするが、記録の保管について都道府県、独立行政法人医薬品医療機器総合機構(平成16年4月設立)、業界団体の協力の可能性も含めて検討する。