�����v�|
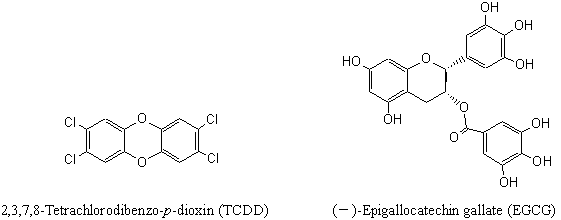
�@�_�C�I�L�V���ނ̓Ő������Ɋ֗^����A�����Y�����f��e�́iAh���Z�v�^�[�j�̊������ɑ���H�i�̗}�����ʂɂ��āAAh���Z�v�^�[�ƃ_�C�I�L�V���ނƂ̔����𗘗p�����Ő����̓o�C�I�A�b�Z�C�@�iCALUX�A�b�Z�C�y��Ah�C���m�A�b�Z�C�j�𗘗p���Č������s�����B�܂��A���o�C�I�A�b�Z�C�@���A�{�ړI�̈ꎟ�X�N���[�j���O�@�Ƃ��đÓ��ł��邱�Ƃ��m�F�����B���Ȃ킿�A�_�C�I�L�V���ނ̒��ōł��Ő��̋���2,3,7,8-tetrachlorodibenzo-p-dioxin�iTCDD�j�ɂ��Ah���Z�v�^�[�������ɑ��āA���̃A���^�S�j�X�g�Ƃ��ĕ���Ă���Β����o���y��(�])-epigallocatechin gallate�iEGCG�j�̗}�����ʂ����������B���̌��ʁA������̃o�C�I�A�b�Z�C�@��p���Ă��Β����o����EGCG�͔Z�x�ˑ��I�ɗ}�����ʂ������A���A�b�Z�C�@���X�N���[�j���O�Ɏg�p�ł��邱�Ƃ��������ꂽ�B�����ŗ��o�C�I�A�b�Z�C�@��p���A��A�ʕ��A�n�[�u�E���ނ��܂ތv39��̐H�i�����̊ܐ��A���R�[�����o���ɂ��āA�ꎟ�X�N���[�j���O�����݂��B���̌��ʁA�n�[�u�E���ނ̒��ł̓Z�[�W���o���A��ł͂ق�����Ȃǂ̗Ηt��A�ʕ��ł͊��k�ނ̒��o�����ATCDD�ɂ��Ah���Z�v�^�[�������ɑ���}�����ʂ��������B�Z�[�W�́A�������������̒��ōł������A�R���g���[���Ɣ�r����CALUX�A�b�Z�C��79���AAh�C���m�A�b�Z�C��83���̗}�����ʂ������A�����͔Z�x�ˑ��I�ɔF�߂�ꂽ�B����̌��ʂ́A�C���r�g���ł̈ꎟ�X�N���[�j���O�̂��߁A�����܂ł��\���I�ȃf�[�^�ł��邪�A�������̐H�i�ɂ�Ah���Z�v�^�[�̊�������}������t�@�N�^�[�̑��݂��������ꂽ�B
�������͎�
�������i�H�i�q��������
�@�V�q�g�́A��@�q��
��������g
�@��������
���R��w��w��
�@�g�c���u
A. �����ړI
�@�_�C�I�L�V�������͍��ۓI�ɂ��[���Ȗ��ł���A�䂪���ɂ����Ă�����9�N�x����u�_�C�I�L�V���ޑ��������������Ɓv���J�n����A���̔����@�\����ԂȂǂ���������Ă����B����猋�ʂ܂��A�_�C�I�L�V���팸�ɑ�����g�݂��A�s������l���x���Ɏ���܂ł��̑Ώ����s���Ă��Ă���A������p�����āA�팸�Ɍ�������w��N�����ׂ��ł���B����ŁA�_�C�I�L�V���ɂ�錒�N���X�N�ɂ����ڂ���K�v������B��N�x�A���Ȃɂ�����u���w������Ɋւ���ӎ������v�ɂ��A�_�C�I�L�V���ނȂǂ̉��w�����ɂ��āA�����̖�7���ȏオ�s���������Ă��邱�Ƃ����炩�ƂȂ����B�]���āA���̃��X�N��ጸ���A�Љ�I�s������菜�����Ƃ�������g�ނׂ��ۑ�̈�Ƃ��Ă�������B
�@���퐶���̒��ŁA�_�C�I�L�V���ނ̃��X�N�Ƃ��ē��ɖ��Ƃ����̂́A��ʔ��I�ɂ�邢����}���Ő��̖��ł͂Ȃ��A���ʔ��I�ɂ�閝���Ő��A���Ȃ킿�����x���̉����ł̐l�̂ւ̉e���i���K�����C���B�Ő��C�Ɖu�Ő��Ȃǁj�ł���B�q�g���ێ悷��_�C�I�L�V���ނ́A���̑唼���H�i�R���ŁA�H�i�������Ő��̃��X�N�̌����ƍl�����Ă���B�������A���݂̉����ł́A�_�C�I�L�V���ނ̑̓��ւ̎�荞�݂��[���ɂ��邱�Ƃ͕s�\�ł���B�H�i����̃_�C�I�L�V���ێ�͔������Ȃ����C�H�i�̗��_�i�_�C�I�L�V���ނ̓Ő���}���ł�����q�̑��݁j��Nj�����A�H�i�o�H����̃_�C�I�L�V���ނ̃��X�N���y�����邱�Ƃ����҂ł��A�H�i�q����̏d�v�Ȓm���ɂȂ�B
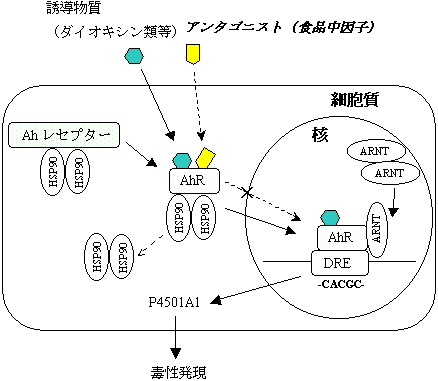
�@�ߔN�A�����������_�C�I�L�V���ނ̐l�̕��ׂ̒ጸ��H�i�ɋ��߂錟�����������s���Ă��Ă���B�Ⴆ�A�H���@�ۂ�N�����t�B���Ƀ_�C�I�L�V���ނ̔r�����i�����҂����������Ă���B����ŁA�_�C�I�L�V���ނ̓Ő������ɂ̓_�C�I�L�V����e�̂Ƃ�������A�����Y�����f��e�́iAh���Z�v�^�[�j�̊������̊֗^���w�E����Ă���A���̊�������}��������q�Ɋւ��錟�����s���Ă��Ă���BAh���Z�v�^�[�͎�e�̌^�]�ʈ��q�ŁA�זE���ɂ����ĔM�V���b�N�^���p�N���iHsp90�j�ƕ����̂��`�����Ă���A�_�C�I�L�V�����̗U�������iAh���Z�v�^�[�����������j��������Ah���Z�v�^�[�ƌ�������ƁAHsp90����𗣂��Ċj���Ɉڍs����BAh���Z�v�^�[�͊j���ł�Ah receptor translocator�iArnt�j�ƌĂ��j�^���p�N�ƃw�e���_�C�}�[���`�����AP4501A1��`�q�㗬�ɎU�݂���Dioxin responsive element�iDRE�j��F�����Č������A�]�ʂ�����������B�]���āA����Ah���Z�v�^�[�̌���������}������悤�Ȉ��q�����݂���A�Ő������}�������҂ł���i�}1�j�B����ɂ��ẮA�H�i�����Ƃ��ăt���{�m�C�h�ށA���J�e�L���ނȂǂɂ��̌��ʂ��������������Ă���B�������A�H�i���̂̃x�l�t�B�b�g���l�����������͖R�����A����Ȃ��b�f�[�^�̏W�ς��v�������B
�@�����ō���A�H�i���̃_�C�I�L�V���ނ̃��X�N�ጸ���Ɋ�^������邽�߁A�H�i���ɑ��݂���_�C�I�L�V���ނ̓Ő�������}������\���̂�����q�̌����ɂ��āA�����ɒ��肵���B�]�����@�́A�ߔN�A��X�̃_�C�I�L�V���ȈՕ��͖@����Ă���Ă���A����炪�_�C�I�L�V���̓Ő����J�j�Y���𗘗p�������@�ł��邱�Ƃɒ��ڂ��ACALUX�A�b�Z�C��Ah�C���m�A�b�Z�C�����̈ꎟ�X�N���[�j���O�Ƃ��ėp���邱�Ƃɂ����BCALUX�A�b�Z�C�́AAh���Z�v�^�[�̃R���g���[�����ɂ����`�q���A���V�t�F���[�[������`�q�ɑg�������n���g�p������̂ŁA���K���h�ƐG�ꂳ���邱�Ƃ�P4501A1�E�^���p�N�ƃ��V�t�F���[�[�E�^���p�N�̗��������B���A���V�t�F���[�[�̔����ʂ𑪒肷�邱�Ƃ�Ah���Z�v�^�[�������������i�_�C�I�L�V���ށj��ʓI�Ɍ��o���邱�Ƃ��ł���BAh�C���m�A�b�Z�C�́AAh���Z�v�^�[�A���K���h�y��Arnt���������������̂�DRE�ƌŒ艻�����A�R�́A���F����̓Y���ɂ�蔭�F���邻�̔��F�ʂ𑪒肷�邱�ƂŁA���K���h-Ah���Z�v�^�[�����\�𑪒�ł���B�����A�b�Z�C�@��K�p���A�܂�Ah���Z�v�^�[�������ɑ���H�i�̗}�����ʂ��X�N���[�j���O�����B
B. �������@
1. ����
�@�����s���̃X�[�p�[�}�[�P�b�g�ōw���������N���12��i�A�X�p���K�X�A�u���b�R���[�A�ɂ�A���イ��A�Ȃ��A�s�[�}���A���܂ȁA���^�X�A���ڂ���A��������A������A�ق�����j�A���N�ʕ�13��i�A�����J���`�F���[�A��A�A�{�K�h�A�o�i�i�A�O���[�v�t���[�c�A�L�E�B�[�A�������A���C���A�т�A�I�����W�A�p�p�C���A�t�B���s���}���S�[�A�������j�A�y�ѐH�i�f�ނƂ��ē���o�����n�[�u�E���ށi�����i�j14��i�o�W���A�[���A�V�i�����A�N���[�u�A�R�[�q�[�A�O�@�o�t�A���x���_�[�A�E�[�������A�I���K�m�A�y�p�[�~���g�A���[�Y�}���[�A�Z�[�W�A�Β��A�g���j�A�v39��������Ƃ����B
2�D����A���t�y�ё��u
�@�G�^�m�[���i��������j�Adimethyl sulufoxide�iDMSO�j�i�����w�p�j�A2,3,7,8-tetrachlorodibenzo-p-�@dioxin�iTCDD�j�́A�a������H�Ƈ�����p�����B(�])-Epigallocatechin gallate�iEGCG�j�i�����Ȋw�����p�j�́A�i�J�n�����w�А���p�����BRPMI1640�|�n�A�y�j�V����/�X�g���v�g�}�C�V���n�t�A�����_�ɏՐ����H�����A0.25%�g���v�V���n�t�́A�i�J���C�e�X�N�А���p�����B���َ������iFBS�j�́AInvitrogen�А����ALysis����A���V�t�F���[�[�A�b�Z�C�V�X�e���́APromega�А���p�����BAh�C���m�A�b�Z�C�L�b�g�́A�N�{�^�Ђ����肵���B�}2��TCDD��EGCG�̍\�����������B
�z���W�i�C�U�[�́A���{���@���쏊�А��}���`�u�����_�[�~�����g�p�����B�}�C�N���v���[�g���[�_�[�́A�a������H�ƎА��T�����C�Y�N���V�b�N���A���~�m���[�^�[�́Aanthos�А�lucy1 microplate luminometer���g�p�����B
3�D�����n�t�̒���
�@�����́A���ׂă}���`�u�����_�[�~���ŋώ������A��A�ʕ��ɂ��ẮA����50 g�����ꂼ��50���ܐ��G�^�m�[��100 mL�Ńz���W�i�C�Y��A�z����߂��s���A����ꂽ��t�������Z�k��A�������������B�n�[�u�E���ނ́A���ꂼ��10 g�l�ɏ��������B���������������̂��A��A�ʕ��ɂ��Ă�100 mg/mL�ɁA�n�[�u�E���ނ�10 mg/mL�AEGCG��10 mM�ɂȂ�悤��DMSO�Œ������A�����n�t�Ƃ����B
4�D�]�����@
�i1�jCALUX�A�b�Z�C�ɂ��]��
�@�����n�t�i�R���g���[����DMSO�j�i4 ��L�j��RMPI1640�|�n�i+8��FBS+�P���y�j�V����/�X�g���v�g�}�C�V���j�i400 ��L�j�ɉ����ĝ��a��A���̂���100 ��L���A96���}�C�N���v���[�g���̃}�E�X�̃K���זEH1L1�i��1.5�~105 cell/well�j��1�E�F�����������B�v���[�g�~�L�T�[��10���ԐU�Ƃ���A�|�n�ɓY������2.4 nM TCDD�𔘘I���A20�`24���ԁACO2�C���L���x�[�^�[�i37���C5��CO2�Z�x�j�Ŕ|�{�����B�|�{��A�|�n����菜���A�E�F�������A���������A�זE�̐������m�F�����BLysis ����i30 ��L�j�ōזE�ǂ�n����A�v���[�g�~�L�T�[��10���ԐU�Ƃ������B�U�Ƃ���A10���ԕ��u���A��Ƃ��ă��V�t�F�����i50 ��L�j�������A���~�m���[�^�[�ɂ�蔭���ʁiRLU�j�𑪒肵���B
�i2�jAh�C���m�A�b�Z�C�ɂ��]��
�@96���}�C�N���v���[�g1�E�F���ɑ��A�������T�C�g�]���k�M�������̍זE���o����DRE�CArnt�����������́l�i200 ��L�j����ю����n�t�i�R���g���[����DMSO�j�i1 ��L�j�������A�v���[�g�~�L�T�[��20���ԐU�Ƃ������B�U�Ƃ���A5nM TCDD�iDMSO�n�t�j�i1 ��L�j�𔘘I�����B�u�����N�ɂ�DMSO�̂݁i1 ��L�j���������B����Ƀv���[�g�~�L�T�[��5���ԐU�Ƃ���A30����2���ԁA�C���L���x�[�g���s�����B�E�F�������AELISA�L�b�g�ɂ�茟�o���A�}�C�N���v���[�g���[�_�[�i405 nm�j�ɂ��z���x�����߂��B
�@Ah���Z�v�^�[�̊����͈ȉ��ɂ�苁�߂��B
| �@�@ | �i���j���o1�|�k�iA�|B�j�|�iC�|D�j�l/�iA�|B�j�p�~100 A�FTCDD�Y�����̃R���g���[���̋z���x�i���邢�͔����x�j B�FDMSO�Y�����̃R���g���[���̋z���x�i���邢�͔����x�j C�FTCDD�Y�����̎����̋z���x�i���邢�͔����x�j D�FDMSO�Y�����̎����̋z���x�i���邢�͔����x�j |
C�D��������
1�D�o�C�I�A�b�Z�C�@�̈ꎟ�X�N���[�j���O�ւ̓K�p�ɂ���
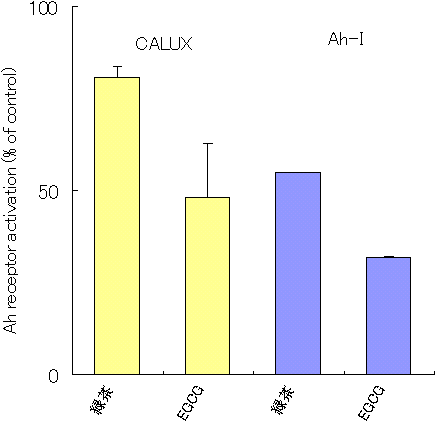
�@�܂��ACALUX�A�b�Z�C��Ah�C���m�A�b�Z�C�̖{�X�N���[�j���O�ւ̓K�p�ɂ��Č��������B�����Ƃ��āA����Ah���Z�v�^�[�̃A���^�S�j�X�g�Ƃ��Ă̌��ʂ�����Ă���Β����o����EGCG��z���R���g���[���Ƃ��ėp�����B�Β����o���ɂ��ẮACALUX�A�b�Z�C�ł͏I�Z�x25 ��g/mL�A Ah�C���m�A�b�Z�C�ł�50 ��g/mL�ɁAEGCG�ɂ��ẮACALUX�A�b�Z�C�ł͏I�Z�x25 ��M�AAh�C���m�A�b�Z�C�ɂ����Ă�50 ��M�ɂȂ�悤�ɒ��������B���̌��ʁA�}3�Ɏ����悤�ɁA�Β����o���ɂ��Ă�CALUX�A�b�Z�C��20���AAh�C���m�A�b�Z�C��45���AEGCG�ł�CALUX�A�b�Z�C��52%�AAh�C���m�A�b�Z�C��68���̗}�����ʂ������AAh���Z�v�^�[�������ɑ���}�����ʂ��A���A�b�Z�C�@�Ŋm�F���邱�Ƃ��ł����B�܂��A�����}�����ʂ͔Z�x�ˑ��I�ɔF�߂�ꂽ�B�]���āA�����o�C�I�A�b�Z�C�@���{�ꎟ�X�N���[�j���O�Ƃ��ēK�p�\�ł��邱�Ƃ���������A�{�@��p���Č������s�����ƂƂ����B
2�D�e��H�i���o���̈ꎟ�X�N���[�j���O�ɂ���
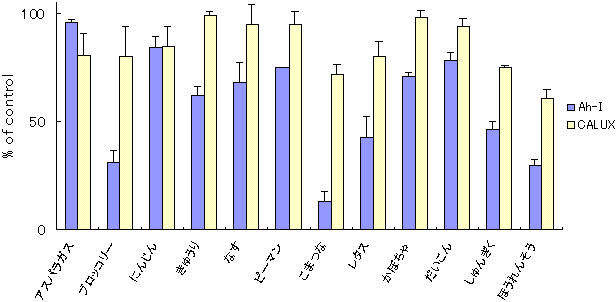
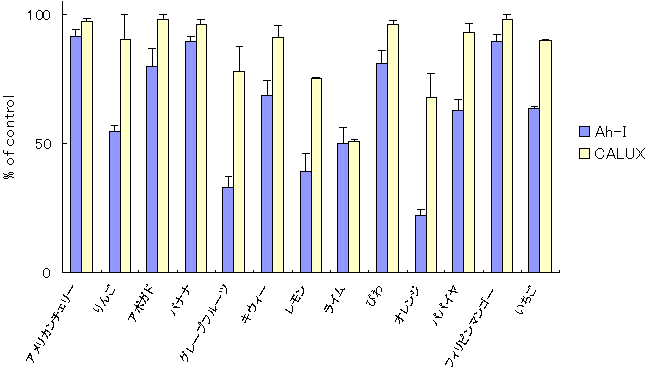
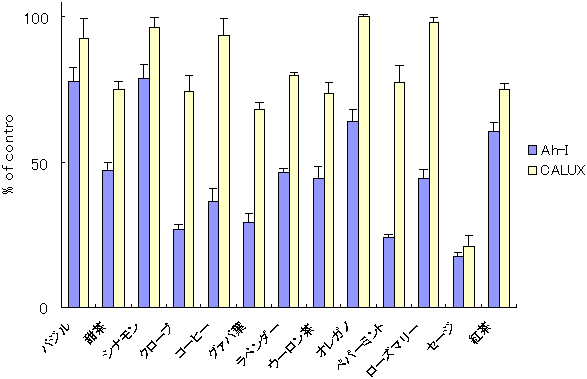
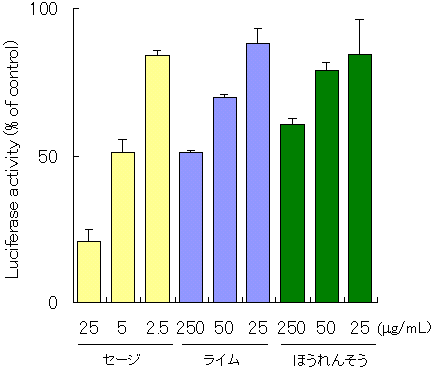
�@C-1�̓K�p�����̌��ʂɊ�Â��A39��̐H�i�����ɂ��Ĉꎟ�X�N���[�j���O���s�����B��A�ʕ����o���ɂ��ẮACALUX�A�b�Z�C�ł͏I�Z�x250 ��g/mL�AAh�C���m�A�b�Z�C�ł�500 ��g/mL�ɁA�n�[�u�E���ނɂ��ẮACALUX�A�b�Z�C�ł͏I�Z�x25 ��g/mL�AAh�C���m�A�b�Z�C�ł�50 ��g/mL�ɂȂ�悤�ɒ��������B�}4�`6�ɂ��̌��ʂ������B�����������ŁA��ł͂��܂ȁA�ق�����Ȃǂ̗Ηt��ɁA�R���g���[���ɑ�CALUX�A�b�Z�C�ł͖�25�`39���AAh�C���m�A�b�Z�C�ł͖�54�`87���̗}�����ʂ��������B�ʕ��̒��ł̓O���[�v�t���[�c�A�������A���C���Ȃǂ̊��k�ނ��ACALUX�A�b�Z�C�ł͖�22�`49���AAh�C���m�A�b�Z�C�ł͖�50�`78���̗}�����ʂ��������B�n�[�u����ނł́A�N���[�u�iCALUX�A�b�Z�C�F26���CAh�C���m�A�b�Z�C�F73���j�A�O�@�o�t�iCALUX�A�b�Z�C�F32���CAh�C���m�A�b�Z�C�F71���j�A�y�p�[�~���g�iCALUX�A�b�Z�C�F23���CAh�C���m�A�b�Z�C�F76���j�Ȃǂ����ɗ}�����ʂ��������B�����͗z���R���g���[���Ƃ��ėp�����Β����o���ɕC�G���邢�͂���ȏ�ł������B���ɃZ�[�W�́ACALUX�A�b�Z�C�ł͖�79���AAh�C���m�A�b�Z�C�ł͖�83���̌����ȗ}�����ʂ��������B
�@�}7�́A�Z�[�W�A���C���A�ق�����ɂ��āA�}�����ʂ̔Z�x�ˑ�����CALUX�A�b�Z�C�ŋ��߂����ʂ����������̂ŁATCDD�ɂ��Ah���Z�v�^�[�̊������ɑ��邻���̗}�����ʂ��Z�x�ˑ��I�ł��邱�Ƃ��F�߂�ꂽ�B
D�D�l�@
�@�{�ꎟ�X�N���[�j���O�̌��ʂɂ����āA���ɗ}�����ʂ̔F�߂�ꂽ���̂��݂�ƁA��ł͂ق�����Ȃǂ̗Ηt��A�ʕ��ł͊��k�ށA�n�[�u�E���ނł̓N���[�u�A�y�p�[�~���g�Ƃ������t���{�m�C�h�ނ̊ܗL���m���Ă�����̂ł���B�������̃t���{�m�C�h�ނ́AAh���Z�v�^�[�̃A���^�S�j�X�g�Ƃ��č�p���邱�Ƃ�����Ă��邱�Ƃ���A�����ɂ����ʂ̉\�����l������B����ŁA���m�Ȃ�V���ȃ^�C�v�̗}���������̑��݂��\���l������B�����V���ȃ^�C�v�̈��q�����炩�ɂȂ�A������v���[�u�Ƃ��邱�ƂŁA�������𖾂ȕ����̑���Ah���Z�v�^�[�̈Ӌ`�𖾂炩�ɂ��邱�ƂɂȂ���A�Ő��y�т����}���邽�߂̐V���ȋ@�\�𖾂Ɍ��т��\��������B�����Ȃ�A�_�C�I�L�V���ɂ�郊�X�N�y���̐V���ȑ�𗧂Ă邱�ƂɂȂ��邩������Ȃ��B����A�{�����̖{���ł�����}�������̌�������т��̖{�̂Ɋւ���X�Ȃ錟�����K�v�Ƃ����B
�@�܂��A����̌��ʁA�y�їΐF��Ɋ܂܂��t�Αf���_�C�I�L�V���ނ�r������������邱�Ƃ��l��������A�����̖�Ȃǂ̐ێ悪�_�C�I�L�V���ɂ�郊�X�N���y�������ŁA�L�Ӌ`�ł��邱�Ƃ����҂����B
�@2�̃A�b�Z�C�@�̌��ʂ��r����ƁA�}��������v���Ȃ����̂�����B�Ⴆ�A�Z�[�W�͗����@�ɂ����ė}���������Ă���iCALUX�A�b�Z�C�ł�79���AAh�C���m�A�b�Z�C�ł�83���j�B���C���ł��قړ����ŁACALUX�ł�49���AAh�C���m�A�b�Z�C�ł�50���̗}���������Ă���B����ŁA�������ɂ����ẮACALUX�ł�25���AAh�C���m�A�b�Z�C�ł�61���A�܂������ł́ACALUX�ł�28���AAh�C���m�A�b�Z�C�ł�87���ł������B����Ɋւ��ẮA���i�K�ł͂����肵�������͂ł��Ȃ����AAh�C���m�A�b�Z�C�͐������זE���g�����ƂȂ��AELISA�v���[�g���Ah���Z�v�^�[�ƃ��K���h�Ƃ̌����������o����C���m�A�b�Z�C�@�ŁA����ACALUX�A�b�Z�C�͔|�{�����}�E�X�̃K���זEH1L1��Ah���Z�v�^�[�̊��������C���r�g���Ō��o���郌�|�[�^�[�W�[���A�b�Z�C�@�ł���B���̌��o�@�̈Ⴂ���A���ʂɉe����^�����̂�������Ȃ��B����A���̐����Ɋւ��錟�����K�v�Ƃ����B
�@�{�����ł́ATCDD�̔Z�x��2.4���邢��5 nM�Ō��������B����͗��A�b�Z�C�@�ɂ����āA���o�\�ȔZ�x�ł��������A���ۂ̑̓��ł̃��x���͖w�ǂ̏ꍇ�A���̔Z�x�����Ⴂ�B����䂦�ɁA����̌��ʂ́A�����܂ł��\���I�ȃf�[�^�Ƃ��ĂƂ炦��ׂ��ł���A����A�������ʂɊւ��邳��ɏڍׂȌ������K�v�ł���B
E�D���_
�@�H�i���_�C�I�L�V���ނ̃��X�N�ጸ���Ɋ�^���邽�߂̌����Ƃ��āA�H�i���ɑ��݂���_�C�I�L�V���ނ̓Ő������}�����q�̌����ɂ��āA�܂��H�i�̗}�����ʂɊւ���\���I�������s�����B�ŏ��ɕ]���@�ɂ��āA�_�C�I�L�V���ނ̓Ő����J�j�Y���𗘗p�����ȈՓŐ����͖@�ł���CALUX�A�b�Z�C�y��Ah�C���m�A�b�Z�C�𗘗p���A�ꎟ�X�N���[�j���O�Ƃ��Ă̓K�p�����������B�z���R���g���[���Ƃ��ėΒ����o�������EGCG��p���Č����������ʁAAh���Z�v�^�[�������ɑ��}�����ʂ��m�F�ł������Ƃ���A�����A�b�Z�C�@��K�p�����B�{�A�b�Z�C�@�ɂ��A��A�ʕ��A�n�[�u�E����39��ɂ��āA�ꎟ�X�N���[�j���O�����݁A���̌��ʁA��ł͂ق�����A���܂ȂȂǂ̗Ηt��A�ʕ��ł̓O���[�v�t���[�c�Ȃǂ̊��k�ށA�n�[�u�E���ނł̓Z�[�W�A�N���[�u�A�y�p�[�~���g�Ȃǂɗ}�����ʂ��F�߂�ꂽ�B�����ɂ̓t���{�m�C�h�ނ̊ܗL���m���Ă���A�����̌��ʂɂ����̂Ɨ\���ł��邪�A�V���ȃ^�C�v�̗}�����q�̑��݂��l�����A���̊����{�̂ɂ��āA����Ɍ��������߂���B
F�D���p����
1�D���Ȋ��ی��������S�ہF���w������Ɋւ���ӎ������i����12�N�x�j�D
2�D�_�C�I�L�V���ނ̐H�i�o�R���ێ�ʒ��������i����10�`12�N�x�j�����������D
3�DToyoda, M., Uchibe, H., Yanagi, T., Kono, Y., Hori, T., Iida, T.: Dietary daily intake of PCDDs, PCDFs and Coplanar PCBs by total diet study in Japan, J. Food Hyg. Soc. Jpn., 40, 98-110 (1999).
4�DTravis, C.C., Hattemer-Frey, H.A.: Human exposure to 2,3,7,8-TCDD, Chemosphere, 16, 2331- 2342 (1987).
5�DBirmingham, B., Gilman, A., Grant, D., Salminen, J., Boddington, M., Thorpe, B., Wile, I., Tofu, P., Armstrong, V.: PCDD/PCDF multimedia exposure for the Canadian population: Detailed exposure estimation, Chemosphere, 19, 637-642 (1989).
6�D�_�C�I�L�V���ނ̔r�����i�Ɋւ��錤���i����11�N�x�j�������D
7�DAozasa, O., Ohta, S., Nakao, T., Miyata, H., Nomura, T.: Enhancement in fecal excretion of dioxin isomer in mice by several dietary fibers, Chemosphere, 45, 195-200 (2001).
8�DSogawa, K., Fujii-kuriyama, Y.: Structure and function of PAS protein: Ah receptor, Arnt, and others, J. Biochem. (Tokyo), 122, 1075-1079 (1997).
9�DReiners, J.J.Jr, Clift, R., Mathieu, P.: Suppression of cell cycle progression by flavonoids: dependence on the aryl hydrocarbon receptor, Carcinogenesis, 20, 1561-1566 (1999).
10�DCiolino, H.P., Daschner, P.J., Yeh, G.C.: Dietary flavonols quercetin and kaempferol are ligands of the aryl hydrocarbon receptor that affect CYP1A1 transcription differentially, Biochem. J., 340, 715-722 (1999).
11�DAshida, H., Fukuda, I., Yamashita, T., Kanazawa, K.: Flavones and flavonols at dietary levels inhibit a transformation of aryl hydrocarbon receptor induced by dioxin, FEBS Letters, 476, 213-217 (2000).
12�DWilliams, S.N., Shih, H., Guenette, D.K., Brackney, W., Denison, M.S., Pickwell, G.V., Quattrochi, L.C.: Comparative studies on the effects of green tea extracts and individual tea catechins on human CYP1A1 gene expression, Chem. -Biol. Interact., 128, 211-229 (2000).
13. Denison, M., Brouwer, A., Clark, G., U.S. Patent 5,854,010 (1998).
14. Ariomori, ., Komori, T., Kawasaki, T.: Flavonol glycosides in leaves of Spinacia oleracea, Phytochemistry, 25, 231-234(1986).
15. Bergman, M., Varshavsky, L., Gottlieb, H.E., Grossman, S.: The antioxidant activity of aqueous spinach extract: chemical identification of active fractions, Phytochemistry, 58, 143-152 (2001).
16. Kawaii, S., Tomono, Y., katase, E., Ogawa, K., Yano, M.: Quantitation of flavonoid constituents in Citrus fruits, J. Agric. Food Chem., 47, 3565-3571 (1999).
17. Lu, Y., Foo, L.Y.: Polyphenolics of Salvia-a review, Phytochemistry, 59, 117-140 (2002).
G�D�������\
1�D�_�����\
Amakura, Y., Tsutsumi, T., Nakamura, M., Fujino, J., Kitagawa, H., Sasaki, K., Yoshida, T., Toyoda, M: Preliminary screening of the inhibitory effect of food extracts on activation of the aryl hydrocarbon receptor induced by 2,3,7,8-tetrachlorodibenzo- p-dioxin, Biol. Pharm. Bull., 25, 272-274 (2002).
2�D�w��\
�V�q�g�́C��@�q���C���������C���쏁�q�C�k��G�q�C���X�؋v���q�C�g�c���u�C�L�c�����F�_�C�I�L�V���ɂ��A�����Y�����f���Z�v�^�[�̊������ɑ���H�i�̗}�����ʁC���{��w���122�N��i2002. 3�j�D