平成13年5月18日
厚生労働大臣 坂口 力 殿ウェルファイド株式会社
代表取締役社長 飯田 晉一郎
平成13年3月19日付命令書(厚生労働省発医薬第166号)にてご指示賜りましたフィブリノゲン製剤に関する各種報告項目のうち、別紙2に該当する5項目につきまして、下記のとおりご報告申し上げます。
今回の報告内容はフィブリノゲン製剤を使用した疾患やフィブリノゲン製剤投与後の肝炎発生状況に関するものであります。調査には数多くの医療機関及び医師のご協力をいただきましたが、医療現場におけるフィブリノゲン製剤の使用はそのほとんどが今から13年以上をさかのぼる昭和63年(1988年)以前でありましたので、当時の実態を正確に把握することは極めて難しく、報告の内容はいくつかの前提をおいた推定とならざるを得なかったことをご理解賜りますようお願い申し上げます。
実施した調査の概略
平成13年3月19日付命令書(以下、命令書という)の別紙2に回答するため、今回新たに医療機関に協力を求めて、医療機関としての調査及び個々の医師に対する調査を実施したほか、これを補完するために昭和62年の調査結果の再解析を行った。その概略を以下に示す。
(1)今回の医療機関及び医師に対する調査(以下、今回の調査という)
命令書 別紙1の1から3までの製剤のうち、肝炎の発症リスクのあった 1.フィブリノゲン製剤(非加熱)と 2. フィブリノゲン製剤(加熱)についての納入本数と納入医療機関のデータが現存しているのは昭和55年以降であり、非加熱と加熱の合計納入本数は 538,300本であった。このうち、528,300本(98.1%)が緊急安全性情報を配布した昭和63年以前に納入されているが、調査にあたっては非加熱・加熱・S/D処理等の製剤の種類を問わず、フィブリノゲン製剤を使用した経験のある医師へのアンケート調査を実施した。
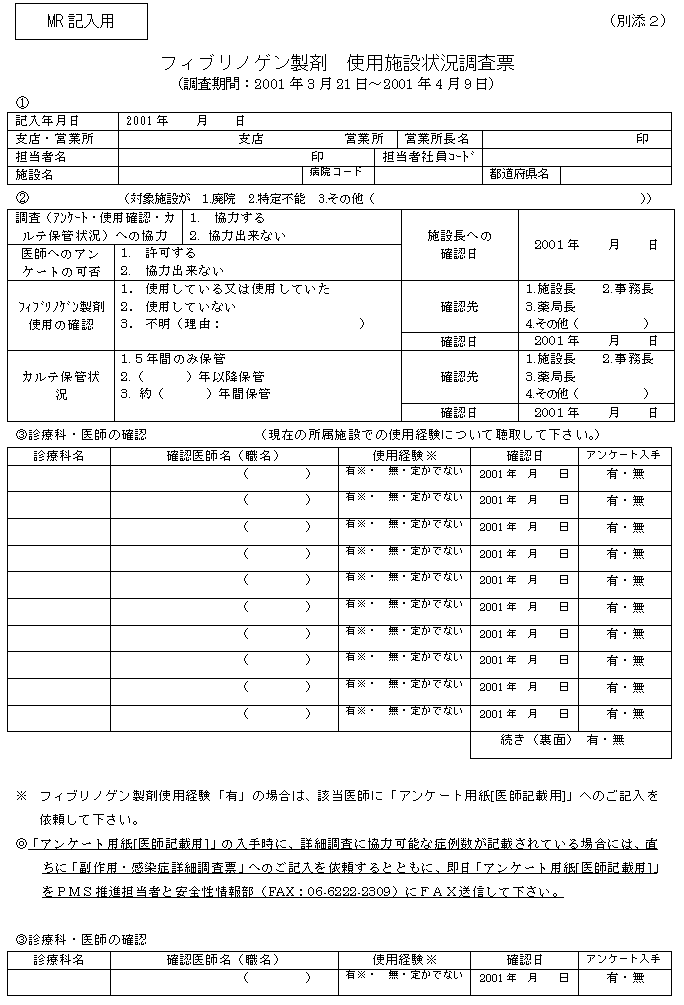
医師へのアンケート調査に先立っては、医療機関の長に調査への協力を依頼して許可を得るとともに、医療機関毎にカルテの保管状況について聴取した。
今回の調査の方法と結果の概略は別添1に、また、調査に用いた「使用施設状況調査票」及び「アンケート用紙[医師記載用]」は別添2、別添3にそれぞれ示した。
(2)昭和62年から平成4年までの加熱製剤投与症例に関する調査(以下、昭和62年調査という)
昭和62年5月の厚生省薬務局安全課・監視指導課・生物製剤課(いずれも当時)の指導に基づき、昭和62年6月のフィブリノゲンHT-ミドリの発売時期から平成4年末までの6年間にわたって、肝炎の発生状況の調査が行われている。この調査は肝炎が現実に発生していた時期に行われていること、及び本剤の投与が行われた段階で症例を把握して6ヵ月間追跡したプロスペクティブな調査であったことから、肝炎発生率の推定に有用な資料と考え、新たにデータ入力を行って解析した。なお、昭和62年から平成4年までの調査のうち、調査初期の結果は昭和62年11月5日、昭和63年4月5日及び同年5月6日付でそれぞれ報告済みである。
命令書 別紙2に対する回答
| 1.納入及び使用を確認した上で、その事実が確認された医療機関について、どのような診療科において、どのような症状に用いられていたか、フィブリン糊としての使用があれば、どのような診療科において、どのような症状に用いられていたかを明らかにすること。 |
(1)情報が得られた医療機関及びカルテ保管期間
弊社が現在保有する昭和55年以降のフィブリノゲン製剤の納入先データの総数は 7,004軒である。そのうち、廃院・休院や統廃合となっている医療機関(681軒)、納入データが「その他△△市」等となっているため納入先を特定できなかった医療機関(458軒)、調査への協力を得られなかった医療機関(223軒)、納入と返品で相殺されて納入数がゼロとなっている医療機関(37軒)、施設コードが重複していた医療機関(30軒)、農学部等の医療機関以外の施設や動物実験等医療目的外に使用していた施設(22軒)及び、院内で対応を検討中の医療機関(5軒)など1,456軒を除く5,548軒から情報が得られた。
なお、納入データが残っている昭和55年以降の7,004軒の中には、納入数がマイナス(返品)となっている施設や納入と返品で相殺されて納入数ゼロとなっている施設が含まれており、昭和55年以降平成12年末までに実際に納入があったのは6,523軒と考えられた(平成13年3月26日付「命令書(厚生労働省発医薬第166号)に対するご報告」の別紙1)が、フィブリノゲン製剤の使用疾患や肝炎発生状況を把握することを目的とした今回の調査においては、そのような施設でもフィブリノゲン製剤が使用されていた可能性を考慮し、データの残っている7,004軒のすべてについて調査を行った。
カルテの保管期間については、5,033軒の医療機関から回答が得られた。そのうち、診療科によって保管期間が異なるなど区分けの困難な130軒を除く4,903軒の集計結果は表1のとおりであり、カルテの保管期間が10年以内の医療機関が4,140軒(84.4%)を占めた。
表1 カルテの保管期間
| カルテの保管期間 | 回答軒数 | (%) |
| 5年間まで | 3,005軒 | (61.3%) |
| 5年間超〜10年間まで | 1,135軒 | (23.1%) |
| 10年間超〜20年間まで | 387軒 | (7.9%) |
| 20年間超(永久含む) | 376軒 | (7.7%) |
| 計 | 4,903軒 | (100.0%) |
(2)診療科及び主な使用疾患(静注)
医師への聞き取り調査を実施できた3,852軒の医療機関に所属する医師7,841名に弊社MRがフィブリノゲン製剤の使用経験の有無を確認し、1,637名の医師から「使用経験あり」との回答を得た。
一方、医師記載アンケート用紙は1,821軒から2,743枚を回収できたが、使用経験がないとの回答も含まれており、アンケート項目のいずれかに具体的な回答のある有効アンケートは1,628枚であった。なお、アンケートは弊社のMRが個々の医師に直接記入を依頼し回収することを原則としたが、医療機関単位または診療科単位で調査が行われ、1枚のアンケート用紙にまとめて回答された例もある。
有効アンケート1,628枚のうち、フィブリノゲン製剤の使用疾患について記載があったのは1,280枚であり、フィブリノゲン製剤の静注での使用疾患については963枚から情報が得られた。その集計結果は表2のとおりであり、産婦人科(産科、婦人科を含む)が最も多かったが、外科系・内科系を問わず広範な診療科で使用されていた。
表2 フィブリノゲン製剤を静注で使用した診療科と主な使用疾患・用途
| 診療科名 | 回答 枚数 |
主な使用疾患・用途(件数、複数回答あり) |
| 産婦人科、産科、婦人科 | 608枚 | 胎盤早期剥離・腟壁裂傷等の産中・産後の出血(499件)、播種性血管内凝固(70件)、低フィブリノゲン血症(28件)、卵巣癌・子宮癌等の手術時(12件)、先天性低フィブリノゲン血症(6件)等 |
| 外科 | 137枚 | 癌等の手術時(43件)、播種性血管内凝固(31件)、出血性胃潰瘍・吐血・下血等の消化管出血(29件)、肝硬変・食道静脈瘤破裂等の肝疾患(16件)等 |
| 内科 | 82枚 | 播種性血管内凝固(15件)、先天性低フィブリノゲン血症(13件)、出血性胃潰瘍・吐血・下血等の消化管出血(12件)、肝硬変・食道静脈瘤破裂等の肝疾患(11件)、白血病および白血病治療薬による低フィブリノゲン血症(8件)等 |
| 小児科 | 27枚 | 白血病および白血病治療薬による低フィブリノゲン血症(12件)、先天性低フィブリノゲン血症(10件)、播種性血管内凝固(5件)等 |
| 消化器科、胃腸科 | 12枚 | 出血性胃潰瘍・吐血・下血等の消化管出血(4件)、肝硬変・食道静脈瘤破裂等の肝疾患(4件)、播種性血管内凝固(3件)等 |
| 血液(内)科 | 12枚 | 白血病および白血病治療薬による低フィブリノゲン血症(5件)、播種性血管内凝固(4件)等 |
| 心臓(血管)外科 | 11枚 | 心臓・血管の手術時(7件)等 |
| 泌尿器科 | 9枚 | 腎臓等の手術時(5件)等 |
| 脳(神経)外科 | 7枚 | 播種性血管内凝固(2件)、大量出血等(1件)等 |
| 胸部外科 | 6枚 | 胸部の手術時(3件)等 |
| 救急部 | 5枚 | 大量出血等(2件)、外傷(1件)等 |
| 麻酔科 | 5枚 | 手術時(1件)、大量出血等(1件)等 |
| 呼吸器外科 | 5枚 | 肺切除術時(1件)、肺癌(1件)等 |
なお、今回の調査結果に、昭和62年調査等で得られている情報を加えて、フィブリノゲン製剤の静注での使用疾患、用途を別添4に示した。
(3)診療科及び主な使用疾患(フィブリン糊)
上記(2)と同様、377枚のアンケート回答からフィブリノゲン製剤のフィブリン糊としての使用疾患・用途について情報が得られた。
その集計結果は表3のとおりであり、外科系の占める割合が多かったが、静注の場合よりもさらに広範な診療科において多様な疾患や手術時の止血や組織接着などに使用されていた。
表3 フィブリン糊として使用した診療科と主な使用疾患・用途
| 診療科名 | 回答 枚数 |
主な使用疾患・用途(件数、複数回答あり) |
| 外科 | 156枚 | 肝臓癌等の肝切除面の止血(28件)、大動脈瘤(16件)、胃癌、胃潰瘍等の手術時(11件)、肺癌・肺嚢胞の肺切除面の止血と空気漏れ防止(9件)、気胸に対する胸膜接着(8件)、腸管吻合(4件)、胆石除去(結石をフィブリン塊に包埋して取り除く方法)(3件)等 |
| 心臓(血管)外科 | 37枚 | 腹部又は胸部大動脈瘤の手術時(13件)、心筋梗塞・狭心症に対するバイパス手術時(7件)、弁膜症・弁置換術(6件)、先天性心疾患の手術時(4件)、人工血管のプレクロッティング(1件)等 |
| 脳(神経)外科 | 37枚 | 脳出血等の脳血管障害の手術時(10件)、脳腫瘍の手術時(8件)、硬膜接着(5件)、髄液漏れの防止(5件)等 |
| 整形外科 | 24枚 | 骨折等(6件)、骨接合(3件)、骨移植(3件)等 |
| 産婦人科、産科、婦人科 | 21枚 | 子宮癌・子宮筋腫等の手術時(5件)等 |
| 泌尿器科 | 15枚 | 腎結石等の尿路結石除去(結石をフィブリン塊に包埋して取り除く方法)(13件)等 |
| 内科 | 12枚 | 気胸に対する胸膜接着(2件)等 |
| 胸部外科 | 9枚 | 心臓バイパス術(1件)、弁置換術(1件)等 |
| 救急部 | 8枚 | 食道静脈瘤(2件)、気胸に対する胸膜接着(1件)等 |
| 呼吸器(内)科 | 7枚 | 気胸に対する胸膜接着(5件)、肺癌・肺嚢胞の肺切除面の止血と空気漏れ防止(3件)等 |
| 呼吸器外科 | 6枚 | 気胸に対する胸膜接着(1件)、気管瘻(1件)等 |
| 消化器科、胃腸科 | 5枚 | 肝生検(2件)、胃癌・胃潰瘍等の手術時(1件)等。 |
| 口腔外科 | 5枚 | 口腔腫瘍の手術時(2件)、口腔形成術(1件)等 |
| 消化器外科 | 5枚 | 肝臓癌等の肝切除面の止血(3件)等 |
なお、今回の調査結果に、昭和62年調査等で得られている情報を加えて、フィブリノゲン製剤のフィブリン糊としての使用疾患、用途を別添5に示した。
|
2.別紙1の1から3までの製剤によると推定される肝炎の発生率、発生概数を明らかにすること。
3.上記2のうち、フィブリン糊としての使用によると推定される肝炎の発生率、発生概数を明らかにすること。 4.上記2及び3に掲げる肝炎の発生概数について、別紙1の1から3までの製剤に係るものと判断した際の判断基準を明らかにすること。 |
2.から4.までの3項目については、今回の調査と昭和62年調査に関する各々の説明中に記述した。
(1)今回の調査からの肝炎の発生率、発生概数の推定
フィブリノゲン製剤の使用症例数と肝炎発生の経験例数、平均使用量、及び使用期間については医師へのアンケートの回答項目に盛り込んだが、医師の記憶に頼らざるを得ない面もあり、2〜3例あるいは1〜2本といった幅のある回答が少なからずあった。このような幅のある回答も貴重な情報と考え、使用症例数や肝炎発生数あるいは平均使用量について幅のある記載の場合には回答の中央の値で集計した。すなわち、2〜3例との記載の場合には2.5例として、また1〜2本との記載の場合には1.5本として集計した。
1)使用症例数と肝炎発生例数、及び肝炎発生率の推定
表4 フィブリノゲン製剤(全体)の使用症例数注1)、肝炎発生例数注1)及び推定肝炎発生率注2)
| フィブリノゲン製剤 | 使用症例数 | 肝炎例数 | 推定肝炎発生率 | |
| 全体 | 静注 | 3,663.5 | 142.5 | 3.9% |
| 糊 | 2,228.5 | 13.5 | 0.6% | |
| 計 | 5,892.0 | 156.0 | 2.6% | |
表5 フィブリノゲン製剤(製剤毎)の推定使用症例数注)、推定肝炎発生例数注)及び推定肝炎発生率注)
| フィブリノゲン製剤 | 推定使用 症例数 |
推定肝炎 発生例数 |
推定肝炎 発生率 |
|
| 非加熱 | 静注 | 3,440.0 | 123.5 | 3.6% |
| 糊 | 1,833.5 | 13.5 | 0.7% | |
| 計 | 5,273.5 | 137.0 | 2.6% | |
| 加熱 | 静注 | 1,970.5 | 65.0 | 3.3% |
| 糊 | 1,806.5 | 1.0 | 0.1% | |
| 計 | 3,777.0 | 66.0 | 1.7% | |
| 加熱+S/D処理 | 静注 | 80.5 | 0.0 | 0.0% |
| 糊 | 0.0 | 0.0 | 0.0% | |
| 計 | 80.5 | 0.0 | 0.0% | |
また、フィブリノゲン製剤の使用量については、静注で826枚、フィブリン糊としての使用で322枚の回答が得られ、これらの回答枚数での平均使用量は、静注で2.16本、フィブリン糊としての使用で1.17本であった。
2)肝炎発生概数の推定
| 各年度の納入数量 | (糊としての推定使用数量) |
| 昭和55年度:56,100本 | |
| 昭和56年度:58,900本 | (−56,100本 = 2,800本) |
| 昭和57年度:65,300本 | (−56,100本 = 9,200本) |
| 昭和58年度:67,800本 | (−56,100本 = 11,700本) |
| 昭和59年度:69,000本 | (−56,100本 = 12,900本) |
| 昭和60年度:73,000本 | (−56,100本 = 16,900本) |
| 昭和61年度:76,500本 | (−56,100本 = 20,400本) |
| ─────────────────────── | |
| 計 466,600本 | (計: 73,900本) |
| (昭和62年度以降の返品:7,700本) | |
| 各年度の納入数量 | (糊としての推定使用数量) |
| 昭和62年度:58,300本 | (×20,400/76,500 ≒ 15,500本) |
| 昭和63年度:11,200本 | (×20,400/76,500 ≒ 3,000本) |
| 平成元年度以降9,900本 | ( 計:18,500本) |
| 計79,400本 |
以上の仮定を基に、納入数量÷平均使用量で推定使用者数を求め、これに推定肝炎発生率を乗じて推定肝炎発生概数を求めて、表6に示した。しかしながら、計算に用いた平均使用量は使用症例数での平均ではなくアンケート枚数に基づく平均であることやフィブリン糊としての使用量が既に推測であることなど不確定な要素が多く、極めて粗い推定と考えざるを得ない。なお、表5の推定肝炎発生率の説明で述べたごとく、使用時期に応じて製剤毎に割り振っているため、推定肝炎発生概数は各製剤の和と全体とは一致していない。
表6 フィブリノゲン製剤投与後の推定肝炎発生概数
| フィブリノゲン 製剤 |
推定使用 数量注1) |
平均 使用量 |
推定使用 者数注2) |
推定肝炎 発生率 |
推定肝炎 発生概数注3) |
|
| 全体 | 静注 | 445,900本 | 2.16本 | 206,435例 | 3.9% | 8,051例 |
| 糊 | 92,400本 | 1.17本 | 78,974例 | 0.6% | 474例 | |
| 計 | 538,300本 | − | 285,409例 | 3.0% | 8,525例 | |
| 注1) | 推定使用数量は、データの残っている昭和55年度以降の納入数量から、静注での使用量とフィブリン糊としての使用量を仮定したもの |
| 注2) | 推定使用者数=推定使用数量÷平均使用量 |
| 注3) | 推定肝炎発生概数=推定投与例数×推定肝炎発生率 |
(使用時期で区分けした製剤毎の推定肝炎発生概数)
| フィブリノゲン 製剤 |
推定使用 数量注1) |
平均 使用量 |
推定使用 者数注2) |
推定肝炎 発生率 |
推定肝炎 発生概数注3) |
|
| 非加熱 | 静注 | 385,000本 | 2.16本 | 178,241例 | 3.6% | 6,417例 |
| 糊 | 73,900本 | 1.17本 | 63,162例 | 0.7% | 442例 | |
| 計 | 458,900本 | − | 241,403例 | − | 6,859例 | |
| 加熱 | 静注 | 60,900本 | 2.16本 | 28,194例 | 3.3% | 930例 |
| 糊 | 18,500本 | 1.17本 | 15,812例 | 0.1% | 16例 | |
| 計 | 79,400本 | − | 44,006例 | − | 946例 | |
| 注1) | 推定使用数量は、データの残っている昭和55年度以降の納入数量から、静注での使用量とフィブリン糊としての使用量を仮定したもの |
| 注2) | 推定使用者数=推定使用数量÷平均使用量 |
| 注3) | 推定肝炎発生概数=推定投与例数×推定肝炎発生率 |
(2)昭和62年調査からのフィブリノゲン(加熱)の肝炎の発生率、発生概数の推定
昭和62年から平成4年までの6年間にわたって実施されたフィブリノゲンHT-ミドリ(加熱)投与症例の調査においては、投与された段階で症例を特定し、3,859症例について6ヵ月間にわたって毎月、MRが担当医師に肝炎発生の有無を確認して用紙に記録するとともに、医師の協力が得られた場合には肝炎症例について詳細調査を行っている。しかしながら、対象となった3,859症例について実際に追跡できた期間は患者の退院や転院等によって異なり、また肝炎発生時期も表7に示したとおり一定でないことから、カプラン・マイヤー法によって肝炎発生率を経時的に推定した。
表7 肝炎発生有無別の観察月数
| 肝炎発生 | 観察月数(満) | 計 | |||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7〜 | 不明等 | |||
| なし | 例数 | 327 | 210 | 210 | 162 | 136 | 193 | 2,054 | 138 | 270 | 3,700 |
| % | 8.8 | 5.7 | 5.7 | 4.4 | 3.7 | 5.2 | 55.5 | 3.7 | 7.3 | 100.0 | |
| あり | 例数 | 52 | 69 | 20 | 6 | 5 | 0 | 1 | 2 | 4 | 159 |
| % | 32.7 | 43.4 | 12.6 | 3.8 | 3.1 | 0.0 | 0.6 | 1.3 | 2.5 | 100.0 | |
| 計 | 例数 | 379 | 279 | 230 | 168 | 141 | 193 | 2,055 | 140 | 274 | 3,859 |
| % | 9.8 | 7.2 | 6.0 | 4.4 | 3.7 | 5.0 | 53.3 | 3.6 | 7.1 | 100.0 | |
1)肝炎の内訳及び観察月数の定義
2)肝炎発生率推定対象
| 除外理由 | 例数 |
| 使用理由 | |
| 先天性低フィブリノゲン血症 (患者特定情報が足りず、正確な例数が把握できないため) |
89 |
| 実験等で臨床的使用でないもの | 2 |
| 静注とフィブリン糊としての併用 | 1 |
| 使用理由が未記入 | 87 |
| 観察月数が不明確な症例等(但し上記使用理由のものは除く) | 231 |
| 計 | 410 |
表8 静注例およびフィブリン糊としての使用例における肝炎発生有無別の観察月数
| 使用理由・肝炎症例 | 観察月数(満) | 計 | |||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7〜 | ||||
| 静注 | なし | 例数 | 184 | 65 | 44 | 30 | 35 | 54 | 580 | 36 | 1,028 |
| % | 17.9 | 6.3 | 4.3 | 2.9 | 3.4 | 5.3 | 56.4 | 3.5 | 100.0 | ||
| あり | 例数 | 46 | 58 | 11 | 6 | 5 | . | 1 | . | 127 | |
| % | 36.2 | 45.7 | 8.7 | 4.7 | 3.9 | 0.0 | 0.8 | 0.0 | 100.0 | ||
| 計 | 例数 | 230 | 123 | 55 | 36 | 40 | 54 | 581 | 36 | 1,155 | |
| % | 19.9 | 10.6 | 4.8 | 3.1 | 3.5 | 4.7 | 50.3 | 3.1 | 100.0 | ||
| 糊 | なし | 例数 | 136 | 144 | 161 | 130 | 97 | 132 | 1,386 | 86 | 2,272 |
| % | 6.0 | 6.3 | 7.1 | 5.7 | 4.3 | 5.8 | 61.0 | 3.8 | 100.0 | ||
| あり | 例数 | 3 | 11 | 8 | . | . | . | . | . | 22 | |
| % | 13.6 | 50.0 | 36.4 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 100.0 | ||
| 計 | 例数 | 139 | 155 | 169 | 130 | 97 | 132 | 1,386 | 86 | 2,294 | |
| % | 6.1 | 6.8 | 7.4 | 5.7 | 4.2 | 5.8 | 60.4 | 3.7 | 100.0 | ||
3)肝炎発生率の推定
肝炎発生率推定値=1−推定値 | |||||||||||||||||||||||||||||||||
|
4)肝炎発生概数の推定
表10 昭和62年調査結果からのフィブリノゲン製剤(加熱)投与後の推定肝炎発生概数
| フィブリノゲン 製剤 |
推定使用 数量注1) |
平均 使用量 |
推定使用 者数注2) |
推定肝炎 発生率 |
推定肝炎 発生概数注3) |
|
| 加熱 | 静注 | 60,900本 | 3.64本 | 16,731例 | 12.7% | 2,125例 |
| 糊 | 18,500本 | 1.75本 | 10,571例 | 1.0% | 106例 | |
| 計 | 79,400本 | − | 27,302例 | − | 2,231例 | |
| 注1) | 推定使用数量はデータの残っている昭和55年度以降の納入数量から、静注での使用量とフィブリン糊としての使用量を仮定したもの |
| 注2) | 推定使用者数=推定使用数量÷平均使用量 |
| 注3) | 推定肝炎発生概数=推定使用者数×推定肝炎発生率 |
(3)今回のアンケート調査からの推定と昭和62年のプロスペクティブ調査からの推定について
昭和62年調査に基づく肝炎発生率は、今回の調査結果に基づく推定発生率に比べて、特に静注例での肝炎発生率が高かった(12.7% 対3.3%)。その原因は必ずしも明らかではないが、次のことが考えられる。
表11 フィブリノゲン製剤(加熱)の推定肝炎発生率と輸血併用の有無
| 肝炎例数 (うち、輸血併用例数) |
肝炎例のうち、 輸血併用例の割合 |
推定肝炎 発生率 |
推定肝炎発生率のうち、 輸血併用例を除いた 肝炎発生率 |
|
| 今回の 調査注1) |
65.0(22.0) | 33.8% | 3.3% | 2.2% |
| 昭和62年 調査注2) |
127例 (輸血有無を確認できる 88例中68例) |
77.3% | 12.7% | 2.9% |
| 注1) | 表5の加熱製剤の静注での推定肝炎発生例数、推定肝炎発生率に輸血併用例数の情報を加えたもの |
| 注2) | 表8の静注での肝炎例数と表9の肝炎発生率推定値に、輸血の有無を確認できる肝炎発症例における輸血併用率の情報を加えたもの |
今回の調査と昭和62年調査の推定肝炎発生率の違いは、上記のごとく、主として肝炎発生例数中の輸血併用例の占める割合の違いとみることができ、推定肝炎発生率のうちの輸血併用例を除いた肝炎発生率を、推定肝炎発生率×(1−輸血併用例の割合(%)/100)として試算すると、今回の調査で2.2%、昭和62年調査で2.9%と近似した値となることから、今回のアンケート調査では比較的実態に近いフィブリノゲン製剤による肝炎の発生状況を把握できたのではないかと考えられる。
| 5.別紙1の1から3までの製剤を使用したが、肝炎ウイルスに感染していないと推定される率及びその概数を明らかにすること。 |
今回の調査によって、ウイルス学的検査でC型肝炎と確認されている18例の症例情報が新たに入手され、今回の調査以前に情報を入手していた21例と合わせて、C型肝炎と確認された症例の総計は39例となった。しかしながら、フィブリノゲン製剤を投与したが肝炎ウイルスに感染していない率及びその概数を直接に推定するに足る情報は今回の調査においては入手できず、また、文献も見出せなかった。
そこで、上記の表4及び表5の推定肝炎発生率と、文献上にみられる輸血後の肝炎非発症例でのC型肝炎ウイルス(HCV)抗体陽転状況から、フィブリノゲン製剤投与後の肝炎ウイルスに感染していない率の推定を試みた。
HCV抗体スクリーニング開始(平成元年)以前の国内における輸血患者230例の観察では、肝炎発症例37例中10例にHCV抗体陽転がみられ、肝炎を発症しなかった症例の中にも3例のHCV抗体陽転があったと報告されている(表12)。また、海外においても肝炎非発症例でのHCV抗体陽転例が報告されており、肝炎発症例数に対する比は0.074〜0.200であった(表12)。
表12 輸血後の肝炎発症例数とHCV抗体陽転例数
| 報告者(報告年) | 観察 症例数 |
肝炎発症例数 (うち、HCV抗体陽転例数) |
肝炎非発症例でのHCV抗体陽転例数 [肝炎発症例数に対する比]) |
| 大戸ら(1991)1) | 230 | 37 (10) | 3 [0.081] |
| Estebanら(1990)2) | 280 | 27 (24) | 2 [0.074] |
| Petersら(1993)3) | 1,476 | 33 (10) | 4 [0.121] |
| Barcenaら(1994)4) | 127 | 10 (6) | 2 [0.200] |
これらの文献での「肝炎」はALT(GPT)値が連続して2回以上正常上限の2倍を越えるなどの診断基準が定められているのに対し、前記の表4に示した「肝炎」は統一的な診断基準を設けていない点で異なっているが、あえて、表4・表5の推定肝炎発生率と表12の最も高い比(0.200)を用いて、フィブリノゲン製剤投与後の肝炎ウイルスに感染していない率及びその概数を推定すれば表13のとおりである。
すなわち、それぞれの製剤での肝炎ウイルスに感染していないと推定される率(推定非感染率)は、100−(それぞれの製剤での推定肝炎発生率×1.2) により求め、また、肝炎に感染していないと推定される概数(推定非感染概数)は製剤毎の推定使用者数に推定非感染率をかけて算出した。
しかしながら、表4及び表5の肝炎の発生率が既に推定した値であることなど不確定な要素が多く、表13の肝炎非感染率や推定非感染概数はおおまかな目安を示したものと考えざるを得ない。
表13 フィブリノゲン製剤投与後に肝炎ウイルスに感染していないと推定される率及びその概数
| フィブリノゲン製剤 | 推定使用者数注1) | 推定非感染率注2) | 推定非感染概数注3) | |
| 全体 | 静注 | 206,435例 | 95.3% | 196,733例 |
| 糊 | 78,974例 | 99.3% | 78,421例 | |
| 計 | 285,409例 | − | 275,154例 | |
(製剤毎の推定肝炎発生率に基づく推定)
| フィブリノゲン製剤 | 推定使用者数注1) | 推定非感染率注2) | 推定非感染概数注3) | |
| 非加熱 | 静注 | 178,241例 | 95.7% | 170,577例 |
| 糊 | 63,162例 | 99.2% | 62,657例 | |
| 計 | 241,403例 | − | 233,234例 | |
| 加熱 | 静注 | 28,194例 | 96.0% | 27,066例 |
| 糊 | 15,812例 | 99.9% | 15,796例 | |
| 計 | 44,006例 | − | 42,862例 | |
文献
1)大戸 斉ら:HCV抗体スクリーニングによる輸血後肝炎の減少. 日本輸血学会雑誌, 37(5), 627-631, 1991.
2)Esteban, J.I., et. al.: Evaluation of antibodies to hepatitis C virus in a study of transfusion-associated hepatitis. New England Journal of Medicine, 323, 1107-1112, 1990.
3)Peters, T., et. al.: Frequency of hepatitis C in acute post-transfusion hepatitis after open-heart surgery: A prospective study in 1,476 patients. Journal of Medical Virology, 39, 139-145, 1993.
4)Barcena, R., et. al.: Prevalence of antibodies to hepatitis C virus after blood transfusion in heart surgery. Postgraduate Medical Journal, 70, 572-575, 1994.
以上
(別添1)
調査方法
1.調査対象医療機関の特定、調査協力依頼と聞き取り調査
弊社が現在保有する昭和55年以降のフィブリノゲン製剤の納入先データの全てを現在の支店・営業所毎に整理して、今回の調査用の施設ID番号を付与し、1軒毎に納入先を特定し、調査結果を記録した。
2.医師へのアンケート調査
調査結果の概略
1.調査対象医療機関の特定、調査協力依頼と聞き取り調査の結果
| 7,004軒 | (入力ミスや納入・返品で納入数0となっている医療機関を含めた、今回の調査対象総数) | |
| ├→ │ │ │ │ │ ↓ |
1,456軒 | 廃院・休院(672軒)、統廃合(9軒) 納入データが不正確(その他△△市等)で特定不能(458軒)、 面談不能又は調査に協力を得られず(223軒) 納入無し(納入・返品で相殺等)(37軒) 施設コードの重複(30軒) 医療機関以外・医療目的外の使用(22軒) 医療機関で対応検討中(5軒) |
| 5,548軒 | (なんらかの情報が得られた医療機関数) | |
2.医師へのアンケート調査の結果
| 医師への聞き取り調査を実施できた医療機関数 | 3,852軒 |
| 医師記載アンケート用紙を実際に回収できた医療機関数 | 1,821軒 |
| (医療機関単位、又は診療科単位で調査が行われた施設を含む。) | |
| 1) | 総回収枚数 | 2,743枚 |
| 2) | 有効アンケート枚数 | 1,628枚 |
| (アンケート項目のいずれかに具体的な記載のあった枚数) | ||
| 3) | 使用症例数についての具体的回答枚数 | 820枚 |
| 4) | 使用疾患・用途についての具体的回答枚数 | |
| 静注として | 963枚 | |
| フィブリン糊として | 377枚 | |
| 5) | 肝炎発症例数についての具体的回答枚数 | 101枚 |
| 疾患名 | 具体的な記載例 | |
| 先天性低フィブリノゲン血症 | 先天性無フィブリノゲン血症、先天性異常フィブリノゲン血症 | |
| 後天性低フィブリノゲン血症 | 産科疾患 | 急性胎盤早期剥離、羊水血栓症、羊水塞栓症、常位胎盤早期剥離、DIC型後産期出血、死児稽留症候群、分娩時大量出血、子宮頚管裂傷、大量子宮出血、弛緩性子宮出血、帝王切開、分娩後弛緩出血、産褥大量出血、子宮収縮不全、前期破水、腟壁裂傷、産褥子宮出血、切迫流産、前置胎盤、流産、子宮破裂、難産道強靭症、産科DIC、腟壁血腫、分娩第IV期出血、子宮内胎児死亡 |
| 婦人科疾患 | 子宮筋腫、子宮頚癌、卵巣癌、機能性子宮出血、子宮内膜増殖症、性器出血、子宮全摘、 | |
| 血液疾患 (白血病除く) |
悪性貧血、赤血球過多症、骨髄破壊、不適合輸血、急性溶血、ITP、低蛋白血症、再生不良性貧血、原発性線溶能亢進症、接着因子異常症、血友病 | |
| DIC | DIC、Pre-DIC、血管内凝固症候群、播種性血管内凝固症候群、MOF | |
| 肝疾患 (肝癌除く) |
肝硬変、食道静脈瘤、食道静脈瘤破裂、慢性肝炎、劇症肝炎、妊娠性急性脂肪肝 | |
| 消化器疾患 | 膵壊死術後、多発性結腸憩室出血、胃潰瘍、消化器穿孔性潰瘍、出血性胃潰瘍、消化管出血、下血、出血性潰瘍、十二指腸潰瘍 穿孔性腹膜炎、非特異性小腸潰瘍、腸閉塞、上部消化管出血、吐血 | |
| 手術侵襲 | 術中・術後の出血、胸郭手術時強度手術侵襲、膵切除、開心術、術後DIC、術後腹腔内出血、肝切除、前立腺切除術 | |
| 外傷 | 広範囲の火傷、頭部外傷、頭蓋底骨折、全身打撲、交通外傷、右下腿の切創、左肋骨骨折、右大腿骨骨折、右肘関節骨折 | |
| 悪性腫瘍(血液) | 白血病、急性リンパ性白血病 、骨髄性白血病、L-アスパラギナーゼ(ロイナーゼ)使用による低フィブリノゲン血症、急性骨髄性白血病、ホジキン病、悪性リンパ腫、成人T細胞白血病、悪性細網球症 | |
| 悪性腫瘍(固形) | 肺癌、胃癌、前立腺、食道癌、総胆管癌、結腸腫瘍、結腸癌、乳癌、肝癌 | |
| 感染症 | 敗血症性ショック、非定型抗酸菌症、腹腔内膿瘍、肺結核症、細菌性心内膜炎、肺炎、汎発性ムコール症 | |
| その他の部位の出血 | 突発性腎出血、喀血、後腹膜腔血腫、血尿、多臓器出血、膀胱出血、脳内出血、大量鼻出血、肺出血 | |
| 部位不特定の出血 | 大量出血、出血多量、出血性ショック、出血傾向(原因不明)、急性失血性貧血 | |
| 詳細不明の低フィブリノゲン血症 | 低フィブリノゲン血症(詳細不明)、無フィブリノゲン血症、低線維素原血症 | |
| 第XIII因子欠乏症 | 先天性第XIII因子欠乏症 | |
(別添5)
| 部位 | 疾患・術式・目的 | 具体的な記載例 |
| 脳・神経 | 脳腫瘍 | 脳腫瘍、悪性脳腫瘍、トルコ鞍部 ganglioma、右前頭洞 mucocele、頭蓋咽頭腫、聴神経鞘腫、聴神経腫瘍、頭蓋骨腫瘍、嗅神経芽細胞腫、血管神経腫、脊髄腫瘍、下垂体腫瘍 |
| 脳血管障害 | 脳血管障害、脳動脈瘤、脳動脈瘤破裂、くも膜下出血、脳梗塞、もやもや病、内頚動脈閉塞、硬膜外血腫、脳出血 | |
| 脳動静脈奇形 | 脳動静脈奇形、硬膜動静脈奇形 | |
| 頭部外傷 | 頭部外傷、視神経損傷 | |
| その他脳・神経疾患 | 髄膜炎、水頭症、頭蓋底陥入症 | |
| 硬膜接着 | 硬膜接着、硬膜縫合 | |
| 神経吻合 | 神経吻合、神経接合術 | |
| その他術式 | 開頭手術、下垂体手術、頭蓋形成術 | |
| 髄液漏れ防止 | 髄液漏れ防止 | |
| 眼 | 眼部腫瘍 | 眼窩内腫瘍 |
| 角膜移植 | 角膜移植 | |
| その他術式 | 結膜弁固定 | |
| 耳鼻咽喉 | 耳鼻咽喉腫瘍 | 真珠腫、中耳腫瘍、咽頭癌 |
| 耳鼻咽喉出血 | 鼻出血 | |
| 耳鼻咽喉外傷 | 外傷性鼓膜欠損 | |
| 中耳炎 | 中耳炎、慢性中耳炎 | |
| 耳鼻奇形 | 中耳奇形、小骨奇形 | |
| 鼓室形成術 | 鼓室形成術、耳小骨連再建術、外耳道形成術 | |
| 鼻中隔手術 | 鼻中隔手術 | |
| 扁桃窩の封鎖 | 扁桃窩の封鎖 | |
| 乳突洞充填 | 乳突洞充填 | |
| 口腔 | 口腔腫瘍 | 口腔腫瘍、口唇腫瘤 |
| その他口腔疾患 | 歯肉出血 | |
| 口腔形成術 | 口蓋形成術、口腔前庭形成術、 | |
| 抜歯後歯槽封鎖 | 抜歯後歯槽封鎖 | |
| 呼吸器、胸部 | 呼吸器腫瘍 | 巨大肺のう胞、巨大気腫性肺のう胞、両側巨大ブラ、肺癌、結腸癌肺転移 |
| 胸部腫瘍 | 縦隔腫瘍、甲状腺癌、胸腺腫、癌性胸膜炎、乳癌 | |
| 呼吸器出血 | 気管支出血、気道出血、肺出血 | |
| 肺動静脈瘻 | 肺動静脈瘻 | |
| 呼吸器瘻 | 気管瘻、食道気管支瘻 | |
| 気胸 | 気胸、自然気胸 | |
| 膿胸 | 膿胸 | |
| 肺切除 | 肺切除、下葉切除、全肺切除、肺のう胞切除術 | |
| 肺癒着剥離術 | 肺癒着剥離術 | |
| 胸膜接着術 | 胸膜癒着術、胸膜の接着 | |
| 気管(支)吻合 | 気管吻合、気管支吻合 | |
| 瘻孔閉塞術 | 瘻孔閉塞術、肺瘻閉鎖、胸腔瘻孔充填術 | |
| その他術式 | 開胸術、気管形成術、肺手術、肺縫縮、肺縫合 | |
| 空気漏出防止 | 肺切除面の空気漏出防止 | |
| 心臓・血管 | 先天性心血管奇形 | 心室中隔欠損症、心房中隔欠損症、両大血管左室起始症、ファロー四徴症、先天性リンパ管腫 |
| 心臓弁障害 | 大動脈弁閉鎖不全、僧帽弁閉鎖不全症、僧帽弁狭窄症、三尖弁閉鎖不全、連合弁膜症、大動脈弁閉塞症、三尖弁閉塞症 | |
| 虚血性心疾患 | 虚血性心疾患、急性心筋梗塞、陳旧性心筋梗塞、狭心症、不安定狭心症、冠動脈狭窄、不整脈、川崎病の冠動脈狭窄症 | |
| 大動脈瘤、大動脈解離 | 大動脈瘤、解離性大動脈瘤、胸部大動脈瘤、腹部大動脈瘤、大動脈解離 | |
| 動静脈硬化症・血栓症 | 閉塞性動脈硬化症、下肢血栓症、ASO、バージャー氏病 | |
| その他心・血管疾患 | 心室瘤、心筋症 | |
| 血管吻合 | 血管吻合、微小血管吻合 | |
| 弁置換術 | 僧帽弁人工弁置換術、大動脈弁置換 | |
| バイパス術 | A-Cバイパス術、腹部大動脈バイパス、CABG術 | |
| 人工血管 | 人工血管移植術、人工血管置換術 | |
| 硬化療法 | 大動脈瘤硬化療法 | |
| その他術式 | 開心術、心臓手術、大血管手術、ペースメーカ植込み | |
| プレクロッティング | フィブリンコート人工血管、人工血管プレクロッティング | |
| 止血 | 吻合部出血防止、吻合部止血 | |
| 消化管 | 消化管腫瘍 | 食道癌、直腸癌、胃癌、S状結腸癌、大腸癌、頚部食道癌、直腸癌 |
| 食道静脈瘤 | 食道静脈瘤 | |
| 消化管潰瘍 | 胃潰瘍、十二指腸潰瘍、クローン病 | |
| 消化管瘻 | 直腸瘻 | |
| その他消化管疾患 | 消化管穿孔、直腸出血、消化管出血、食道閉鎖症、腸閉塞 | |
| 消化器切除術 | 食道全摘、大腸切除、胃切除術、膵頭十二指腸切除術 | |
| 消化管吻合 | 消化器吻合、腸吻合、胆管空腸吻合術 | |
| 硬化療法 | 食道静脈瘤硬化術 | |
| その他術式 | 消化器系手術、ERCP後の血管損傷部位 | |
| 止血 | 止血、内視鏡的止血 | |
| 肝臓、胆嚢、膵臓、脾臓 | 肝・胆管・胆嚢・膵腫瘍 | 肝癌、原発性肝癌、転移性肝癌、肝のう腫、肝血管腫、肝のう胞、胆管癌、胆嚢癌、膵頭部癌、膵臓癌 |
| 肝炎・肝硬変 | 肝炎、急性肝炎、慢性肝炎、B型肝炎、非A非B型肝炎、アルコール性肝障害、肝硬変、脂肪肝 | |
| 胆石症 | 胆石症、肝内結石 | |
| その他肝・胆・膵、脾疾患 | 膵液瘻、外傷性肝破裂、脾破裂 | |
| 切除術 | 肝切除術、胆嚢摘出術、膵全摘 | |
| 塞栓術 | 門脈閉塞術、経皮的経肝的門脈塞栓術 | |
| 生検 | 肝生検 | |
| その他術式 | 脾損傷部縫合 | |
| 胆石包埋法 | 胆石包埋法 | |
| 止血 | 止血、肝生検後の止血 | |
| 泌尿器・生殖器 | 泌尿・生殖器腫瘍 | 子宮筋腫、腎癌、膀胱癌、鼠徑部のう胞、前立腺癌 |
| 尿路結石 | 腎結石、尿路結石 | |
| その他泌尿生殖器疾患 | 子宮破裂、頚管無力症、陰嚢水腫、 | |
| 切除術 | 腎臓切除、前立腺切除 | |
| 腎移植 | 腎移植 | |
| その他術式 | 子宮全摘、卵管架橋術、卵管通水治療、筋腫核出 | |
| 腎盂切石術 | コアグラム腎盂切石術 | |
| 骨・関節 | 骨腫瘍 | 骨腫瘍、軟骨腫、骨のう腫 |
| 骨髄炎 | 骨髄炎 | |
| 関節炎・関節障害 | 変形性股関節症、脊髄空洞症、膝変形性関節症、椎間板ヘルニア、慢性関節リウマチ | |
| 外傷性骨・関節障害 | 骨折、骨損傷、大腿骨骨折、外傷性頚椎症、膝半月板剥離、交通外傷、鼻骨骨折、骨軟骨骨折 | |
| その他骨・関節疾患 | 大腿骨頭壊死、右腕神経叢損傷、頚部脊柱管狭窄症、左足底神経損傷、骨性出血 | |
| 骨移植術 | 骨移植術 | |
| 神経移植、神経縫合 | 神経移植、神経縫合、神経・骨吻合、 | |
| 骨接合 | 骨接合、骨軟骨片の接合、半月板接着 | |
| 腱縫合 | 腱縫合、アキレス腱接合 | |
| 脂肪移植 | 脂肪移植 | |
| その他術式 | 脊椎の手術、頚椎前方固定術、腰椎後側方固定術 | |
| 充填 | 骨および軟骨部創傷腔の閉鎖、化膿性骨髄炎等の死腔の補填 | |
| 皮膚 | 熱傷 | 熱傷、火傷 |
| その他皮膚疾患 | 左側部挫創、難治性瘻孔、皮膚欠損 | |
| 植皮術 | 皮膚移植、遊離植皮術、熱傷患者の遊離植皮術 | |
| 皮膚弁の接着 | 裂皮膚弁の接着 |
(別添6)
| No. | 性別 | 一日 投与量 |
初回 投与年 |
投与経路 | 原疾患・使用理由 | 報告副作用・感染症名 | 輸血等の有無 |
| 1 | 女 | 1g | 1982 | 静注 | 先天性無フィブリノゲン血症 | C型慢性肝炎 | |
| 2 | 女 | 2g | 1983 | 静注 | 先天性低フィブリノゲン血症 | B型肝炎、C型肝炎 | |
| 3 | 男 | 2g | 1984 | 静注 | 先天性無フィブリノゲン血症 | C型肝炎 | |
| 4 | 男 | 2g | 1984 | 静注 | 先天性無フィブリノゲン血症 | C型肝炎 | |
| 5 | 女 | 2g | 1983 | 静注 | 先天性無フィブリノゲン血症 | C型肝炎抗体陽性 | 有 |
| 6 | 女 | 5g | 1988 | 静注 | 再生不良性貧血、結節性多発(性)動脈炎 | 肝炎 | 有 |
| 7 | 女 | 3g | 1965 | 静注 | 分娩子癇、重症妊娠中毒症、DIC | HCV感染 | 有 |
| 8 | 男 | 1g | 1978 | 静注 | 先天性無フィブリノゲン血症、マルファン症候群 | C型肝炎 | 有 |
| 9 | 女 | 2g | 1987 | 静注 | 弛緩性出血 | 急性肝炎 | 有 |
| 10 | 女 | 2g | 1986 | 静注 | 弛緩性出血 | 慢性C型肝炎 | 有 |
| 11 | 女 | 2g | 1987 | 静注 | 弛緩出血 | 急性肝炎 | 無 |
| 12 | 女 | 2g | 1987 | 静注 | 弛緩出血 | 急性肝炎 | 無 |
| 13 | 男 | 4g | 1981 | 静注 | 先天性無フィブリノゲン血症、脳出血、筋肉内出血、上顎洞腫瘍手術 | C型肝炎 | 有 |
| 14 | 女 | 2g | 1988 | 静注 | 分娩時の大出血 | 肝炎 | 無 |
| 15 | 女 | 1g | 1976 | 静注 | 先天性無フィブリノゲン血症 | HCV感染 | |
| 16 | 女 | 3g | 1988 | 静注 | 弛緩子宮出血、DIC | 血清肝炎 | 有 |
| 17 | 女 | 1g | 1988 | 静注 | 歯茎からの出血(妊娠37週) | C型肝炎 | 有 |
| 18 | 女 | 1989 | 静注 | 弛緩出血、DIC | NANB肝炎(のちにC型肝炎) | 有 | |
| 19 | 男 | 1g | 1992 | 静注 | 急性リンパ性白血病(アスパラギナーゼ投与) | 肝障害(HCV抗体陽性) | 有 |
| 20 | 男 | 0.1mL | 1987 | フィブリン糊 | 心筋梗塞、冠動脈バイパス術 | C型肝炎 | |
| 21 | 男 | 0.1mL | 1980 | フィブリン糊 | 不安定狭心症、緊急手術 | C型肝炎 | |
| 22 | 女 | 2g | 1987 | 静注 | 弛緩出血、産科DIC | 急性肝炎(非A非B型) | 有 |
| 23 | 女 | 2g | 1986 | 静注 | 先天性無フィブリノゲン血症 | B型肝炎、C型肝炎 | |
| 24 | 女 | 2g | 1987 | 静注 | 分娩時大量出血、切迫早産 | 肝機能障害(黄疸)、C型肝炎 | 無 |
| 25 | 女 | 5g | 1986 | 静注 | 胆石症、胃ポリープ、術後吐・下血著明 | C型慢性肝炎 | 有 |